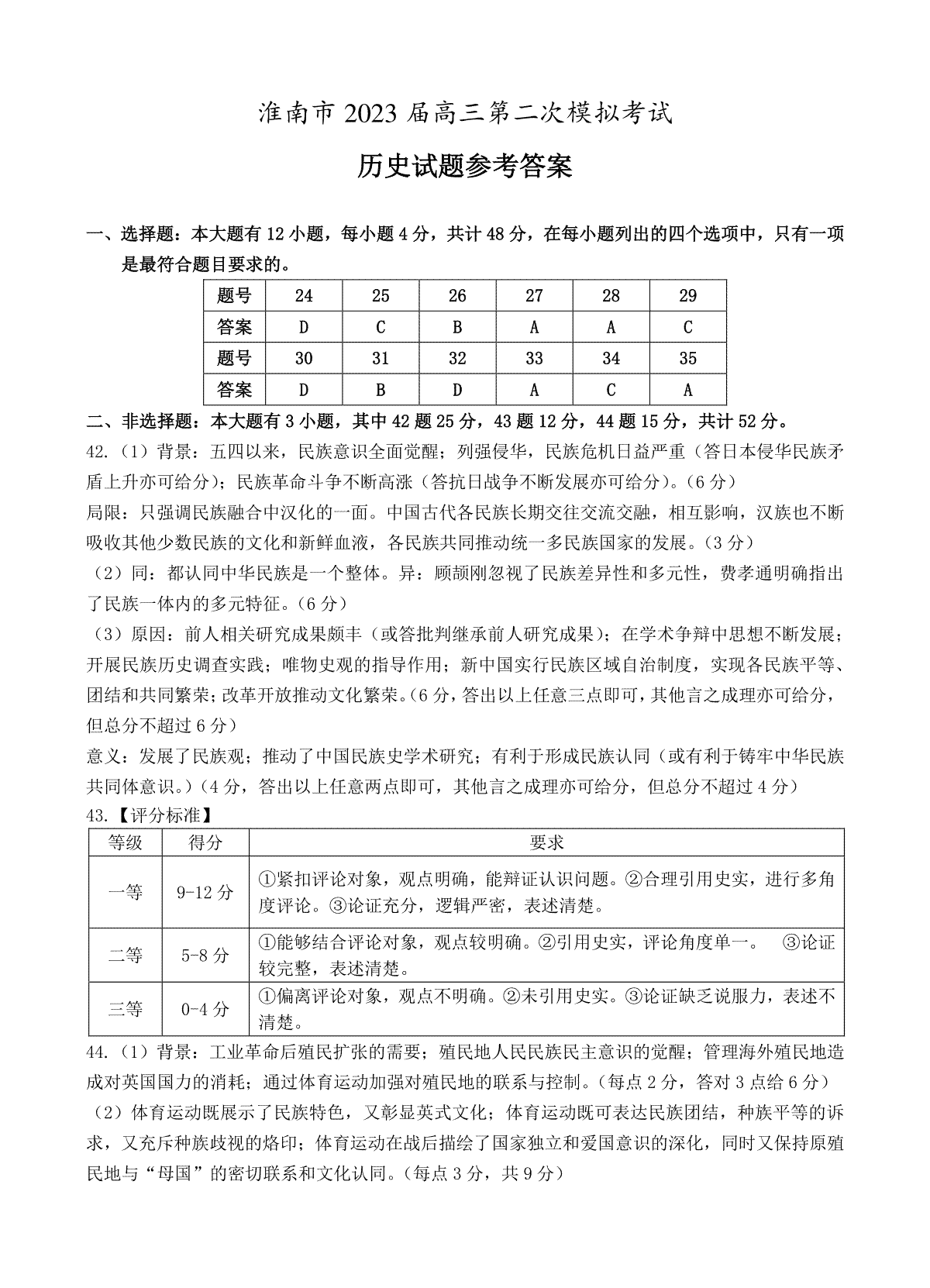
氨气的实验室制法方程式
2020-05-222NH4Cl(固态)+Ca(OH)2(固态)==2NH3↑+CaCl2+2H2O。实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备。分为工业制法和实验室制法。

注意事项
(1)不能用NH4NO3跟Ca(OH)2反应制氨气
因为NH4NO3是氧化性铵盐,加热时低温生成NH3和HNO3,随着温度升高,硝酸的强氧化性发挥作用使生成的氨进一步被氧化生成氮气和氮的氧化物,所以不能用NH4NO3跟Ca(OH)2反应制氨气。
氨的制法
1.工业制法:工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成
工业上制氨气
高温高压
N2(g)+3H2(g)==2NH3(g)(可逆反应)
催化剂
△rHθ=-92.4kJ/mol
2.实验室制备:
实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备:
氨气的四种实验室制法△
2NH4Cl+Ca(OH)2===2NH3↑+CaCl2+2H2O
Li3N+3H2O===LiOH+NH3↑
实验室制NH3不能用NaOH、KOH代替Ca(OH)2
因为NaOH、KOH是强碱,具有吸湿性(潮解)易结块,不易与铵盐混合充分接触反应。又KOH、NaOH具有强腐蚀性在加热情况下,对玻璃仪器有腐蚀作用,所以不用NaOH、KOH代替Ca(OH)2制NH3。